

癌症已经成为威胁我国健康发展的首要致死性疾病,男性和女性在非生殖系统肿瘤的发生和死亡中存在显著的性别偏倚现象,然而背后的免疫学机制仍不明晰。肿瘤的发生发展与高度异质的肿瘤免疫微环境密不可分,阐明雄性发生肿瘤免疫逃逸的机制,将为肿瘤性别差异提供新观点,同时为优化临床癌症免疫治疗提供新的策略。
2022年6月13日,yd12300云顶线路邓刘福教授团队在国际著名期刊Immunity发表了题为Androgen receptor-mediated CD8+ T cell stemness programs drive sex differences in antitumor immunity的研究论文。该研究发现了肿瘤浸润性CD8+ T细胞干性维持能力是调控肿瘤免疫性别差异的关键因素,而内在的雄激素受体(Androgen receptor,AR)信号通路显著抑制干细胞样CD8+ T细胞亚群的维持。该研究为理解肿瘤性别差异提出了新的理论解释,为再认识内分泌系统调控肿瘤免疫应答呈现了新的视角,同时为靶向AR信号通路通过重编程CD8+ T细胞干性增强肿瘤免疫治疗提供了科学依据。

上海交通大学邓刘福教授课题组致力于CD8+ T细胞干性分化规律和逃逸特征的研究。课题组前期研究揭示了内源性cGAS(cyclic GMP-AMP synthase)-STING通路通过维持CD8+ T细胞干性以促进T细胞抗肿瘤免疫应答的作用机制,证明了STING通路的激活可以显著提高人源CAR-T细胞治疗的效果,为临床T细胞治疗的优化提供了新的策略和依据,相关研究成果已发表在转化医学国际著名期刊Science Translational Medicine(2020)。在此期间,课题组惊奇发现,男性的雄激素居然为干细胞样CD8+ T细胞精心编织了“囚笼”,限制了干细胞样的CD8+ T维持,“助纣为虐”促进肿瘤发生免疫逃逸,这为肿瘤发生发展的性别偏倚现象提供了新的理论解释,也对内分泌系统调控肿瘤免疫应答有了新的认识。
在这项研究中,作者团队为了探究肿瘤性别差异的发生机制,首先使用雌性、雄性野生型小鼠构建了皮下肿瘤模型和二乙基亚硝胺诱导肝癌模型,证明了肿瘤发生发展具有雌雄偏倚性,即雄性小鼠肿瘤进展更加恶性。在进一步研究荷瘤小鼠的免疫应答反应时,团队通过使用天然免疫系统重要调节通路的基因敲除小鼠及T细胞删除实验,发现肿瘤发生发展的性别差异依赖于CD8+ T细胞。接着,在荷瘤小鼠T细胞治疗性过继回输实验中,团队发现雌性CD8+ T细胞展现出T细胞回输治疗的强大潜力,相比于雄性来源的CD8+ T细胞,其更能显著抑制肿瘤进展,这进一步表明CD8+ T细胞是介导肿瘤进展性别差异的关键因素。
考虑到CD8+ T细胞在肿瘤免疫循环及免疫治疗中的关键性地位,CD8+ T细胞的性别差异引起了作者团队极大的兴趣。随后,团队深入评价了肿瘤浸润性CD8+ T细胞的效应分子分泌能力和增殖潜力,发现雄性CD8+ T细胞处于“疲劳应战”状态。为了进一步描述肿瘤微环境中CD8+ T细胞的耗竭情况,作者团队检测了T细胞表面抑制性受体分子(PD-1、TIM-3),以及干性维持相关的转录因子TCF-1和表面分子SLAMF6的表达水平,同时也使用了染色质开放测序手段进行深入分析,明确了肿瘤微环境内CD8+ T细胞分化存在性别差异,雄性CD8+ T细胞耗竭程度更深,而雌性CD8+ T细胞的干性维持能力更强,并在临床恶性肿瘤患者单细胞组学数据中对该发现进行了验证。综上,作者团队发现,雌雄肿瘤浸润性CD8+ T细胞分化程序的不同,调控肿瘤发生发展的性别差异,这一观点丰富了人们对肿瘤性别差异发生机制的认知。
男性、女性存在诸多差异,包括性激素及生活方式等,何种性别因素调控了CD8+ T细胞的分化特性呢?雄激素,是男女性别特征发育的主要调控因素,也影响着肠道微生物及免疫系统反应的性别差异,诸如新冠病毒在人群中的性别分布以及自身免疫性疾病发生的性别偏倚等,其被广泛认知具有免疫抑制作用,然而在肿瘤免疫中的发挥怎样的作用尚不明晰。作者团队通过小鼠肿瘤模型的单细胞组学数据发现AR和CD8+ T细胞分化具有相关性,进而借助CD8+ T细胞体外实验和小鼠CD8+ T细胞体内回输模型,阐明了AR信号通路对CD8+ T细胞效应功能和干性维持的抑制作用;同时,在临床男性结直肠癌患者样本中,也观察到CD8+ T细胞耗竭与AR信号通路活性的正相关性,揭示了AR信号通路介导雄性肿瘤免疫逃逸的新机制。
雄激素,素来被冠以男性力量之源,却也为CD8+ T细胞套上了沉重的“枷锁”,这不得不引起科研者对其重新审视。如果打破其对CD8+ T细胞的“禁锢”,是否可以再度激发CD8+ T细胞的抗肿瘤能力呢?为此,基于前期发现,团队进一步将雄激素剥夺手术与免疫检查点抑制剂进行联合,以期探讨AR在免疫治疗中的转化效果,结果发现雄激素水平的降低可协同增强免疫疗法的治疗效果,这为免疫治疗的优化提供了新的启发。值得一提的是,同期Nature和Science immunology也相继发文,共同揭示了AR信号通路活性与肿瘤浸润性CD8+ T细胞的相关性,奠定了AR信号通路在肿瘤免疫中的重要地位。当下,AR受体信号通路阻断剂在前列腺癌中广泛应用,该研究为相关药物在其他癌肿中的推广应用提供了坚实的理论依据,通过干预AR信号通路实现干细胞样CD8+ T细胞的重编程,成为新药开发的重要思路。
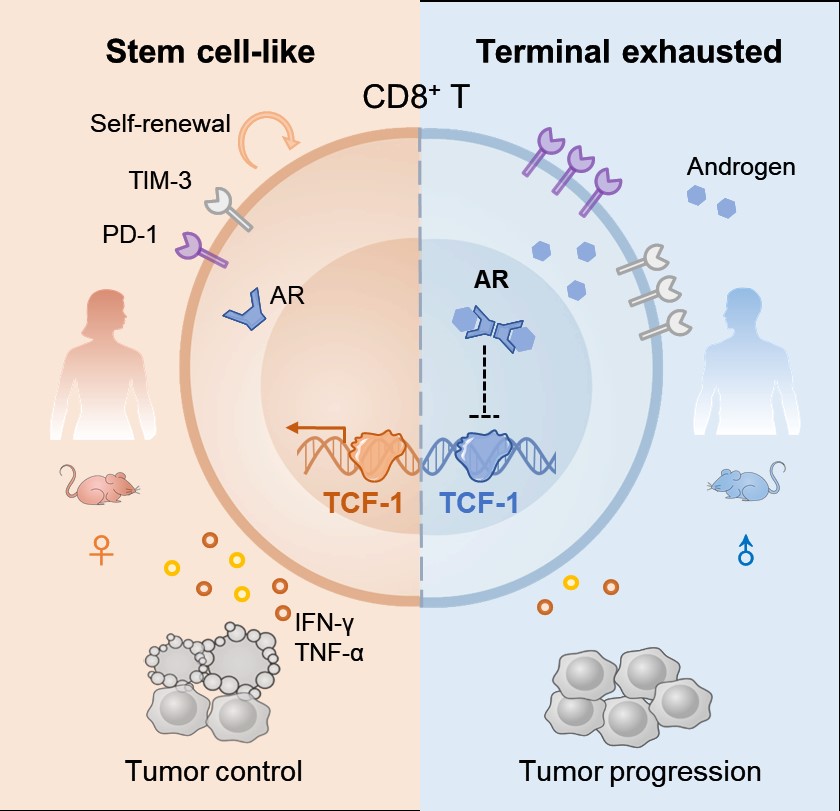
综上所述,该研究揭示了肿瘤性别差异的免疫调节新机制,阐明了干细胞样CD8+ T细胞分化存在性别差异,发现了雄激素参与调控肿瘤免疫逃逸的新途径,明确了内分泌系统、免疫系统和肿瘤之间的内在联系,为靶向AR信号通路增强肿瘤免疫治疗效果提供了新的方向。
该论文的通讯作者是上海交通大学邓刘福教授,上海交通大学博士生杨超和金静思为该论文的共同第一作者。该研究受到了国家自然科学基金、国家海外青年高层次人才计划、上海市科委“科技创新行动计划”、上海交通大学“医工交叉研究基金”等项目资助。
原文链接:
https://doi.org/10.1016/j.immuni.2022.05.012